Met zuivere stof geven we in de scheikunde aan dat het om één stof gaat: de stof bestaat uit slechts één soort moleculen. Deze moleculen zorgen voor de stofeigenschappen van de stof. Zo bestaat zuiver water uit alleen watermoleculen, en zuiver suiker uit alleen suikermoleculen.
Als we verschillende soorten moleculen samenvoegen maken we een mengsel. Zo bevat suikerwater (opgelost suiker in water) zowel water- als suikermoleculen. Suikerwater krijgt dan ook een combinatie van stofeigenschappen: het is een kleurloze transparante vloeistof (een stofeigenschap van de zuivere stof water) en het smaakt zoet (stofeigenschap van de zuivere stof suiker).
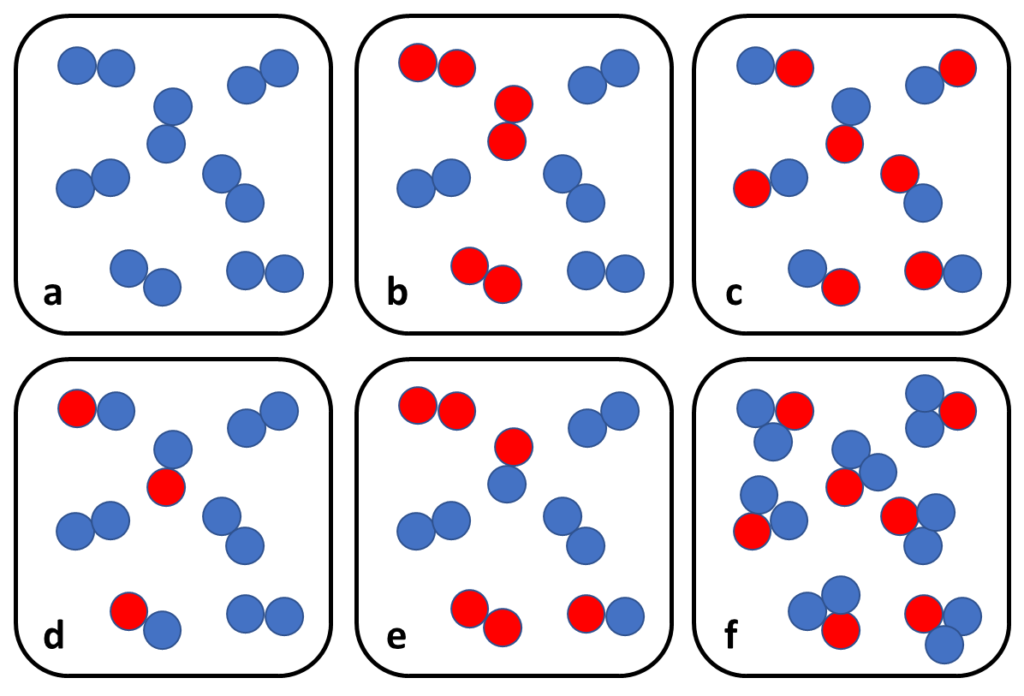
Opdracht 28
Hieronder staan zes tekeningen (a t/m f) waarin schematisch moleculen zijn getekend. Leg voor elke tekening uit:
- of het een zuivere stof of een mengsel voorstelt;
- als het een mengsel is: hoeveel stoffen er door elkaar gemend zijn.
Opdracht 30
Bij het mengen van twee stoffen kunnen er verschillende dingen gebeuren. Soms ontstaat er alleen een mengsel. Maar soms kan er ook een chemische reactie ontstaan!
Leg op op microniveau (het kijken naar de moleculen) uit wat het verschil is tussen mengen waarbij niets gebeurt, en mengen waarbij een chemische reactie ontstaat.
Opdracht 29
Hieronder zie je een het etiket van een pak Appelsientje sinaasappelsap. Er wordt gesproken over ‘puur sap’. Leg uit of Appelsientje scheikundig gezien een zuivere stof is. Gebruik hiervoor de voedingswaarde informatie op het etiket.

Homogeen en heterogeen
We kunnen mengsels onderscheiden in heterogene mengsels en homogene mengsels. Aan een heterogeen mengsel is nog te zien welke bestanddelen in het mengsel zitten. Zo kun je bij beton duidelijk zien dat het cement gemengd is met grind. Soms kun je het niet zo duidelijk met het blote oog zien, maar wel onder een microscoop. Hiernaast staat een foto van een druppel koemelk onder de microscoop. Je kunt zien dat de melk een heterogeen mengsel is van water en kleine vetdruppeltjes.
Bij homogene mengsels kunnen we de afzonderlijke stoffen van het mengsel niet meer onderscheiden. Zout water is hier een voorbeeld van. Maar bijvoorbeeld ook de verschillende soorten gassen in de lucht om ons heen. Bij beide voorbeelden kun je de verschillende soorten stoffen niet meer zien. Ook niet onder een microscoop!

Namen van mengsels
Binnen de scheikunde kennen we verschillende soorten mengsels, elk met een eigen naam. We herkennen ze door te kijken naar de samenstelling. Voor elk van deze soorten mengsels verschilt de aggregatietoestand (fase) van de gemengde stoffen. Je komt ze stiekem in het dagelijks leven veel tegen zonder dat je er misschien ooit over nagedacht hebt! Hieronder staat een uitleg van de 6 mengsels die je moet kennen: bestudeer ze goed!
Oplossing
Oplossingen zijn homogene mengsels: je kunt niet zien dat er verschillende soorten stoffen in voorkomen. Een voorbeeld is suikerwater: de vaste stof suiker is opgelost in water, waardoor je niet langer de suikerkorrels kunt zien. Het oplosmiddel is hier de stof water, de opgeloste stof de suiker. Een oplossing is altijd helder: je kunt er doorheen kijken. Maar dat betekent niet dat een oplossing altijd kleurloos is! Denk maar aan ranja: die is vaak gekleurd maar wel helder. De opgeloste stof hoeft niet altijd een vaste stof te zijn. Bijvoorbeeld bier: grotendeels water, maar het bevat ook opgeloste koolstofdioxide (een gas) én de opgelost alcohol (een vloeistof).
Nevel
Bij een nevel zweven kleine vloeistofdruppeltjes in een gas, bijvoorbeeld bij mist. Het is een heterogeen mengsel.
Suspensie
Een suspensie is een heterogeen mengsel: een vloeistof waarin je kleine brokjes van een vaste stof kunt zien zweven. Elk brokje bestaat nog uit heel veel deeltjes/moleculen van de vaste stof. Samen zijn die deeltjes groot genoeg om het licht te verstrooien. Hierdoor kun je er niet meer goed doorheen kijken: een suspensie is troebel.
Schuim
Soms is een gas als kleine belletjes opgesloten en vormt het een schuim. Scheerschuim bestaat uit kleine gasbelletjes opgesloten in een vloeistof, piepschuim uit gasbelletjes opgesloten in een vaste stof. Het is een heterogeen mengsel.
Emulsie
Een emulsie is een ondoorzichtige, troebele vloeistof waarin druppels van een andere vloeistof zweven. Melk is bijvoorbeeld een emulsie van water en vet. Soms kunnen emulsies na verloop van tijd ontmengen. Er ontstaan dan twee lagen. Denk maar aan olie en water. Als je deze samenvoegt en schudt krijg je een troebele vloeistof, maar na enige tijd zal de olie op het water gaan drijven.
Rook
Rook bestaat uit kleine deeltjes vaste stof (roet) in een gas (de lucht). Het is een heterogeen mengsel.
Opdracht 31
Bekijk de afbeeldingen hieronder. Leg voor elk nummer uit of het om een oplossing, suspensie of emulsie gaat. Zoek eventueel online op uit welke hoofdbestanddelen het mengsel op de foto’s bestaat.

Opdracht 32
Bekijk de afbeeldingen hieronder. Leg voor elk nummer uit of het om een homogeen of heterogeen mengsel gaat.

Opdracht 33
Hieronder staat een woordweb waarin de belangrijkste soorten mengsels worden samengevat.
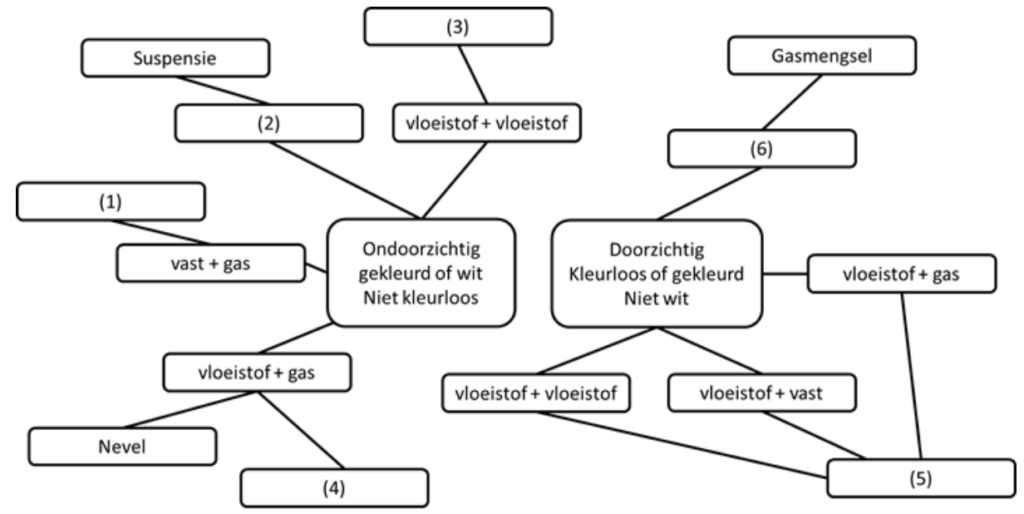
Het woordweb is echter niet volledig. Kies voor elk cijfer een van de volgende 6 mogelijkheden: “oplossing”, “emulsie”, “schuim”, “rook”, “vast + vloeistof”, “gas + gas”.
Practicum: mengsels maken
Kun jij zelf een suspensie, emulsie en oplossing maken? Laat maar eens zien of dat lukt met onderstaande practicum!
Mengsels verwarmen
Soms is het niet zo eenvoudig om te zien of een stof zuiver of een mengsel is. Een heldere, kleurloze vloeistof zou bijvoorbeeld water kunnen zijn, maar ook alcohol, Sprite of 7-up. Om uit te vinden of een stof zuiver is of een mengsel kun je het koken of smelten bestuderen:
Smelt- en kookpunt
Een zuivere stof heeft een specifiek smeltpunt en kookpunt. Dit zijn twee unieke stofeigenschappen. Tijdens het smelten en koken van een zuivere stof veranderen deze temperaturen niet!
Als we bijvoorbeeld zuiver ijs smelten zal gedurende het smelten de temperatuur precies 0oC zijn. Pas als al het ijs gesmolten is kan de temperatuur van het water verder toenemen. Ook zal tijdens het koken de temperatuur precies 100 oC blijven totdat al het water is verdampt. De grafiek zal er dan uitzien zoals hieronder getekend.
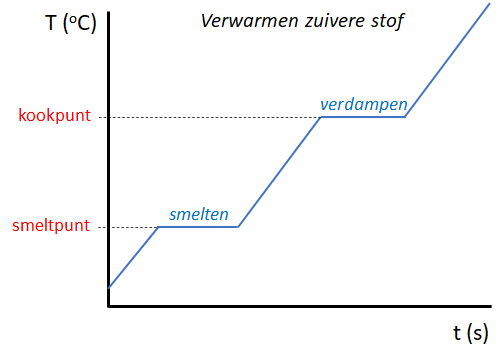
Smelt- een kooktraject
Voor mengsels is dit anders. De verschillende gemengde stoffen hebben elk hun eigen smelt- en kookpunt. Je krijgt voor het mengsel dan een faseovergang die niet precies bij één temperatuur plaatsvindt. In plaats daarvan loopt de temperatuur tijdens de faseovergang iets op: je krijgt een smelttraject en een kooktraject. Kijk maar naar de grafiek hieronder van het verwarmen van een mengsel.
Tijdens de fase-overgangen is de stof aanwezig in beide aggregatietoestanden. Zo zal een stof tijdens het smelten zowel in vaste als vloeibare vorm aanwezig zijn, en tijdens het verwarmen de stof in vloeibare- en gasfase.
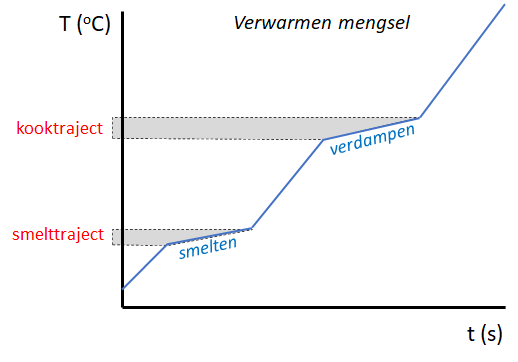
Opdracht 34
Hieronder staat een tabel met smelt- en kookpunten van enkele zuivere stoffen. Beantwoord de onderstaande vragen voor de stoffen in deze tabel. Bekijk eventueel nog eens de uitleg in lesbrief 1.3.
| Stof | Smeltpunt oC | Kookpunt oC |
| Water | 0 | 100 |
| Alcohol | -114 | 78 |
| Stikstof | -210 | -196 |
| IJzer | 2084 | 3296 |
| Kwik | -39 | 357 |
| Waxine | 60 | 370 |
| Olijfolie | -6 | 300 |
- Noteer alle stoffen uit bovenstaande tabel die vloeibaar zijn bij 20°C
- Noteer alle stoffen uit bovenstaande tabel die vast zijn bij -1°C
- Noteer alle stoffen uit bovenstaande tabel die gasvormig zijn bij 350°C
- Reken het smeltpunt en kookpunt om van oC naar Kelvin.
Opdracht 36
Maak de volgende zinnen compleet door het ontbrekende woord in te vullen. Kies uit: kooktraject, kookpunt, smelttraject, smeltpunt, stoltraject, stolpunt, mengsel, zuivere stof, wel, niet, tijd, temperatuur. Een woord mag meerdere keren gebruikt worden.
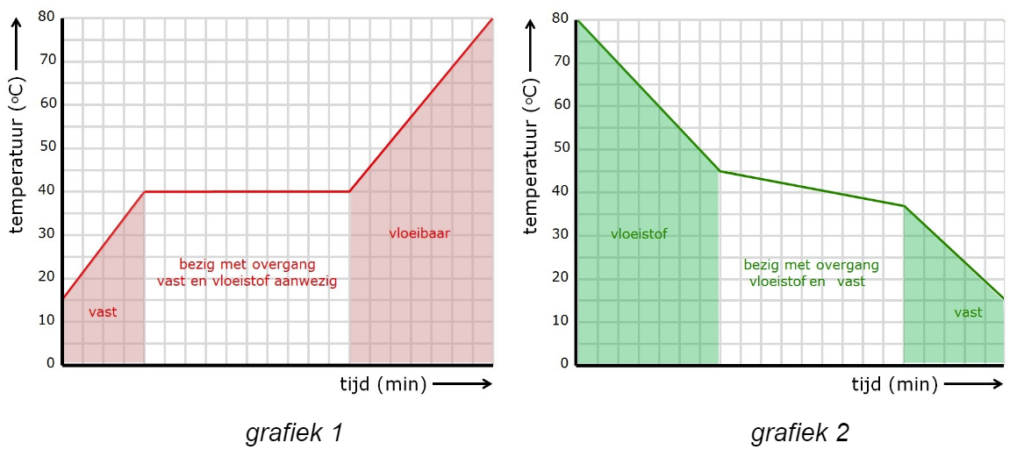
- Grafiek 1 hierboven toont een ________, de onderzochte stof is een _________.
- Grafiek 2 hierboven toont een ________, dat is het kenmerk van een _________.
- Bij een zuivere stof liggen het stolpunt en het smeltpunt op dezelfde ___________.
- Bij een stoltraject verandert de temperatuur _____ tijdens de faseverandering.
- Tijdens het afkoelen van een oplossing moet men een _________ vinden.
Opdracht 35
Daan wil een grafiek maken van het afkoelen van hete, zuivere alcoholdamp. Hij begin met alcoholdamp van 100 oC. Langzaam koelt hij de damp tot maar liefst -150 oC.
- Schets een grafiek van het experiment. Gebruik het kook- en smeltpunt van alcohol uit de tabel in opdracht 34. Geef op de Y-as bovendien de juiste waarde voor het kook- en smeltpunt aan. Noteer ook juiste de grootheid en eenheid op de assen.
- Tijdens de proef vinden twee faseovergangen plaats. Leg uit welke twee overgangen dit zijn en geef van elke overgang de naam.
- Maak voor elke faseovergang uit vraag (b) een vergelijking. De scheikundige naam van alcohol is ethanol. Kijk eventueel nog eens naar lesbrief 1.3 voor de juiste molecuulformule en uitleg hoe je zo’n vergelijking opstelt!
- Geef bij elk lijnstukje in de grafiek aan in welke fase (vast, vloeibaar of gas) of combinatie van fasen (vast + vloeibaar, vloeibaar + gas) de alcohol aanwezig is.
- Leg uit hoe de grafiek zou veranderen als we wodka (mengsel van alcohol en water) in plaats van zuivere alcohol zouden gebruiken bij deze proef.